Evoluzione della Tavola Periodica: un ciclo di conferenze supportato da ParliamoneOra e ospitato dall’Accademia delle Scienze dell’Istituto di Bologna
Margherita Venturi
Socio Benedettino dell’Accademia delle Scienze dell’Istituto di Bologna
Abstract
The Periodic Table should not be seen as a static table, but as something alive which, over the course of 300 years, has undergone an evolutionary process. Starting from this consideration the idea arose of organizing a series of conferences entitled “Evolution of the Periodic Table”.
The term evolution, however, in the case of the Periodic Table has multiple and interesting implications that have been pointed out in the conferences: gradual and orderly growth of the Periodic Table; development of “new” Periodic Tables able to more effectively highlight the periodic law, or aspects relevant to technological progress; evolution from the historical and epistemological point of view of the concept of element; evolution of matter in the Universe which led to the birth and formation of the elements; transformation of the concept of periodicity; evolution of the idea of technological development which must comply with the limits imposed by the Periodic Table because of the availability of elements on our planet; the didactic approach to the evolution of the Periodic Table which is a very powerful tool for letting students enter the world of Chemistry, its language and its order.
Introduzione
La nascita della Tavola Periodica ha rivoluzionato la Scienza perché si tratta di un documento che in una sola pagina, in maniera concisa e apparentemente semplice, fornisce le conoscenze di base per capire come è fatta e come funziona la materia ovunque, nelle stelle, nei pianeti e nel nostro stesso corpo; è un documento con una potenza interpretativa unica, capace di entrare nell’essenza delle discipline scientifiche, ma anche e soprattutto di catturare l’essenza della Natura svelandone l’ordine intrinseco; è, in poche parole, il linguaggio stesso della Natura.
Anche se la data di nascita ufficiale della Tavola Periodica è il 1869 e anche se la sua paternità è attribuita universalmente al chimico russo Dmitrij Ivanovič Mendeleev, la storia di questo documento va ben più indietro nel tempo, dal momento che l’idea di ordinare in qualche modo gli elementi è nata praticamente quando è nata la Chimica. La Tavola Periodica, nonostante non esistesse ancora come tale, ha cominciato a popolarsi nel 1718, anno in cui furono scoperti i primi elementi, e poi è cresciuta nel corso del tempo con l’aggiunta di nuovi elementi, soprattutto quelli artificiali sintetizzati in laboratorio, che hanno riempito posti vuoti e hanno allungato righe e colonne. Questa crescita ha portato alla situazione del 2018 in cui la Tavola Periodica si presenta come un blocco unico e compatto formato da 18 colonne e 7 righe, senza più posti vuoti: dai pochi e sparuti elementi del 1718 si è arrivati agli attuali 118 elementi e forse non c’è la possibilità di aggiungerne altri, almeno in tempi brevi (Fig. 1).
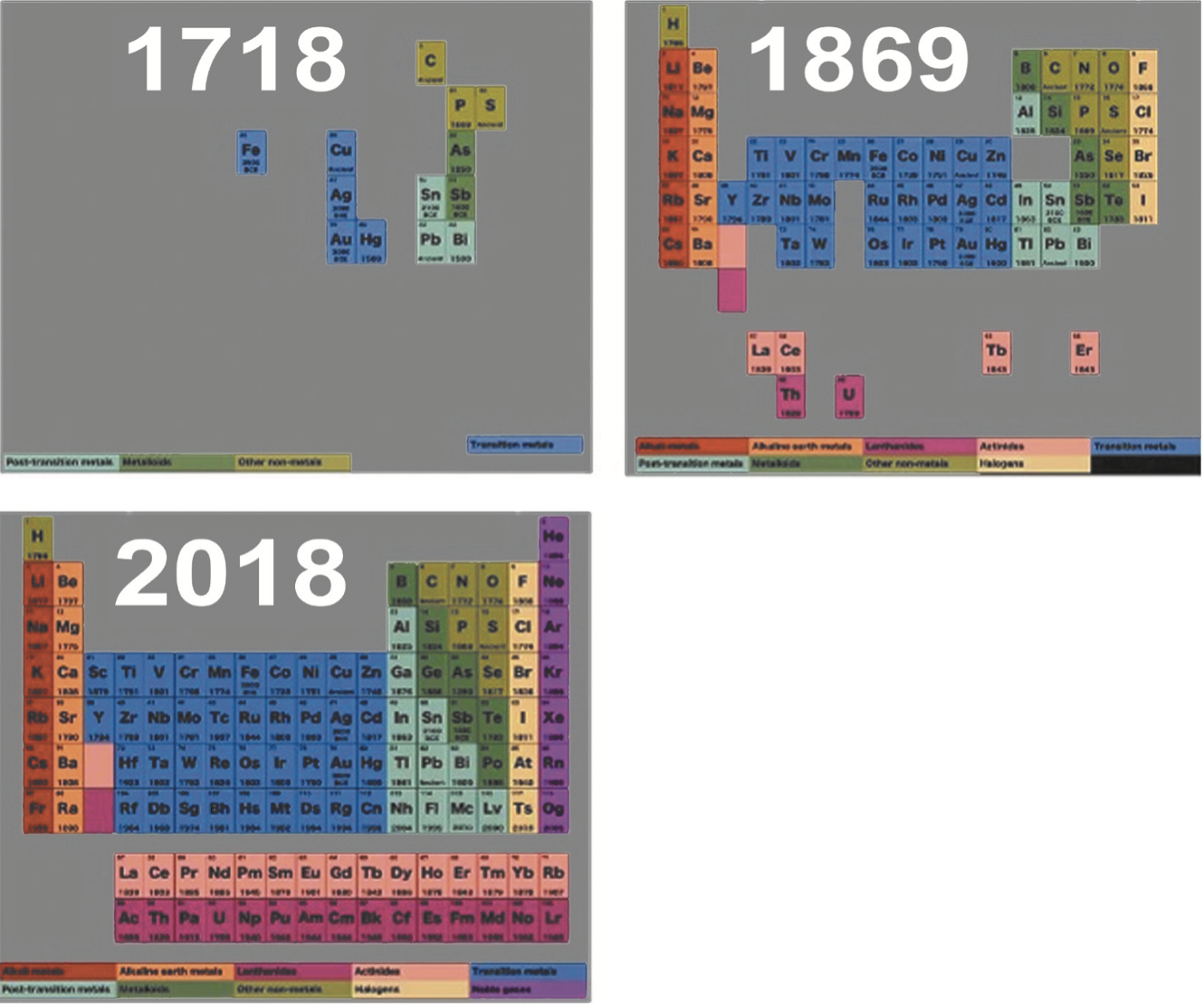
Fig. 1. Evoluzione della Tavola Periodica dal 1718 ad oggi.
La Tavola Periodica, quindi, non deve essere vista come una tabella statica, ma come qualcosa di vivo che, nel corso di 300 anni, ha avuto un processo evolutivo di crescita graduale e ordinata. È proprio da questa considerazione che è partita l’idea di organizzare un ciclo di conferenze, supportato dall’associazione ParliamoneOra (https://www.parliamoneora.it) e ospitato dall’Accademia delle Scienze dell’Istituto di Bologna, a cui è stato dato, appunto, il titolo “Evoluzione della Tavola Periodica”.
Il termine evoluzione, però, nel caso della Tavola Periodica può avere molteplici e interessanti risvolti che sono stati sottolineati nelle conferenze del ciclo: crescita graduale e ordinata della Tavola Periodica che si è popolata di nuovi elementi e che ha coinvolto persone note e altre dimenticate; sviluppo di “nuove” Tavole Periodiche che sono in grado di evidenziare più efficacemente la legge periodica, o aspetti rilevanti per il progresso tecnologico; evoluzione dal punto storico ed epistemologico del concetto di elemento, che con il passare del tempo si è arricchito di molte sfaccettature; evoluzione della materia nell’Universo che ha portato alla nascita e alla formazione degli elementi; trasformazione del concetto di periodicità che, con il “completamento” della Tavola Periodica, potrebbe dover essere declinato in maniera nuova; evoluzione dell’idea di sviluppo tecnologico che deve sottostare ai limiti imposti dalla Tavola Periodica per quanto riguarda la disponibilità degli elementi sul nostro pianeta; l’approccio didattico all’evoluzione della Tavola Periodica che è strumento potentissimo per far entrare gli studenti nel mondo della Chimica, nel suo linguaggio e nel suo ordine.
Di seguito è riportato un breve riassunto delle conferenze, ricordando che sono state tutte registrate e che sono visionabili al seguente link: https://www.parliamoneora.it/levoluzione-della-tavola-periodica-il-programma/.
1. L’evoluzione della Tavola Periodica. Conferenza di Marco Ciardi (Dipartimento di Lettere e Filosofia – Università di Firenze)
L’età dei Lumi segna il momento in cui i valori della modernità raggiungono la massima espressione e il compimento più maturo. L’ideale dell’unità del sapere e della classificazione della realtà si unisce con il desiderio di possedere strumenti di previsione dell’ignoto e dello sconosciuto. L’immagine del cosmo geometrico si lega con quella della natura come labirinto. Le discipline classiche trovano un punto di incontro con i numerosi ambiti, in via di definizione, del sapere sperimentale, aprendo la strada anche all’affermazione della tecnologia. Nascono nuove scienze specifiche e fra queste la Chimica.
La spiegazione della natura delle sostanze ha sempre oscillato, fin dall’antichità, fra teorie di tipo corpuscolare e ipotesi fondate sull’esistenza di elementi: le prime erano in grado di spiegare le caratteristiche primarie delle sostanze, mentre le seconde le qualità visibili. Alla fine del Settecento, queste due immagini della materia trovano un punto d’accordo con l’apporto di nuovi strumenti tipici della filosofia illuministica e, cioè, il concetto di analisi e l’interpretazione strumentale dei fenomeni naturali. Grazie alla Rivoluzione chimica di Lavoisier, gli elementi non rappresentano più principi metafisici stabiliti a priori, ma costituiscono il risultato delle operazioni analitiche effettuate in laboratorio. Lavoisier ne individua 33, molti simili a quelli realmente esistenti, altri inesistenti, come la “luce” e il “calorico”.
Dopo Lavoisier, il chimico inglese Humphry Davy, usando la pila ideata da Alessandro Volta nel 1799, contribuisce a scoprire numerosi nuovi elementi. Lo stesso fa lo svedese Berzelius. All’inizio dell’Ottocento, il fisico inglese John Dalton ipotizza che la regolarità nelle combinazioni fra elementi, che i chimici stanno riscontrando in sempre maggiore misura, sia dovuta alla semplicità di combinazioni fra gli atomi alla base degli elementi. Molti chimici, però, rifiutano di aderire alla teoria atomica, perché la ritengono inutilizzabile sperimentalmente, o troppo impegnativa sotto il profilo filosofico. Comunque, anche fra i sostenitori della teoria atomica regna una gran confusione, perché non esiste un criterio uniforme per definire il peso atomico degli elementi e distinguere chiaramente la differenza tra atomi e molecole. O meglio, il criterio viene formulato dal fisico torinese Amedeo Avogadro nel 1811, il quale propone l’ipotesi che porta il suo nome (e che oggi è una legge): “volumi uguali di gas nelle stesse condizioni di temperatura e pressione contengono lo stesso numero di particelle”. Ma questo criterio, per varie e complesse ragioni, non viene ritenuto valido per molto tempo.
Nel settembre del 1860 viene organizzato a Karlsruhe in Germania un congresso internazionale al quale partecipano delegazioni di chimici da tutto il mondo. Ci sono anche gli italiani e, in particolare, il palermitano Stanislao Canizzaro. Cannizzaro, nel 1858, in quel momento docente all’Università di Genova, utilizzando l’ipotesi di Avogadro è arrivato a stabilire un chiaro criterio per distinguere tra atomi e molecole e, soprattutto, per determinare il peso atomico degli atomi. Ora ha l’occasione di presentare le sue ricerche di fronte ai chimici di tutto il mondo. Fra i partecipanti, due in particolare restano affascinati dall’intervento di Cannizzaro, il tedesco Meyer e il russo Mendeleev. Terminato il convegno Meyer e Mendeleev si mettono al lavoro, ma alla fine sarà Mendeleev a porre le basi del sistema che ancora oggi utilizziamo e che conosciamo come Tavola Periodica.
Mendeleev comprende che la chiave di tutto sta nel peso atomico: bisogna semplificare i diversi sistemi di classificazione chimica e crearne uno solo, che metta in ordine gli elementi chimici esclusivamente sulla base del loro peso atomico. L’ipotesi di Prout, secondo il quale tutti i pesi atomici degli elementi sono multipli di quello dell’idrogeno, non può più essere adottata, perché smentita dalle ricerche di Cannizzaro. Quando nel 1867 diventa professore di Chimica generale all’Università di San Pietroburgo, Mendeleev ha la necessità di adottare un manuale per i suoi studenti. Non trovando testi che lo soddisfano, decide di scriverne uno. La strada che porta alla prima Tavola Periodica degli Elementi nasce, quindi, anche da una esigenza didattica, quella di essere chiari e comprensibili con gli studenti e di proporre loro un sistema di classificazione razionale degli elementi. Così, progressivamente, attraverso vari tentativi, il 1° marzo 1869 Mendeleev arriva alla costruzione della sua prima tavola. È bene ricordare che Mendeleev lavora soltanto su 63 elementi (uno dei quali si rivelerà non esserlo), ma la forza del sistema da lui elaborato sta nella sua straordinaria capacità predittiva. Infatti, pochi anni dopo vengono scoperti tre elementi nuovi che rispondono alle proprietà perviste da Mendeleev e che riempiono alla perfezione alcune delle caselle da lui lasciate bianche.
2. Chi ha contribuito a riempire le caselle della Tavola Periodica? Conferenza di Margherita Venturi (Dipartimento di Chimica “Giacomo Ciamician” – Università di Bologna)
L’evoluzione della Tavola Periodica permette anche di scoprire il volto umano della scienza, perché in ogni casella di questo documento non c’è solo un elemento con le sue proprietà, ma ci sono anche i nomi delle persone che hanno contribuito alla sua nascita e i nomi di quelle che l’hanno fatto crescere aggiungendo nuovi elementi.
È una storia fatta di nomi prestigiosi che si ritrovano in tutti i sacri testi di Chimica; quelli citati sono fondamentalmente nomi maschili, cosa che non è corretta perché anche tante donne hanno contribuito, se non alla nascita della Tavola Periodica, a riempire nuove caselle. Sicuramente Marie Curie, alla quale si deve la scoperta del radio e del polonio, è nota a tutti, ma la lista è lunga e comprende scienziate di gran valore, purtroppo dimenticate; è impossibile citarle tutte, però è doveroso ricordare almeno qualche nome.
Marguerite Perey, la cui vita è intrecciata a quella di Marie Curie perché ha lavorato nel suo istituto, ha scoperto il francio; è stata candidata al Nobel ben cinque volte, ma l’Accademia svedese ha deciso che i suoi studi, pur valendo la pena di essere riconosciuti, non erano così importanti da meritare il premio Nobel. Una giustificazione sicuramente di comodo, dal momento che tanti Nobel sono stati assegnati per la scoperta di nuovi elementi; si è trattato però, guarda caso, solo di scienziati uomini, ad eccezione di Marie Curie.
Altra donna dimenticata è Harriet Brooks che contribuì, assieme a Rutherford, alla scoperta del radon; Rutherford ricevette il Nobel, mentre Harriet non fu neanche nominata.
Altro esempio sicuramente da citare è quello di Ida Noddack a cui si deve la scoperta del renio; anche lei fu candidata quattro volte al Nobel, ma come nel caso della Perey, l’Accademia svedese non la ritenne degna del premio. Ciò, probabilmente, si deve al fatto che la comunità dei fisici non perdonò mai a Ida l’impudenza di aver criticato Fermi quando, nel 1934, annunciò di aver ottenuto un nuovo elemento bombardando con neutroni l’uranio. Con una grande lungimiranza e ipotizzando con largo anticipo il processo della fissione, Ida confutò l’affermazione di Fermi e scrisse in un articolo, “… i nuclei pesanti bombardati con neutroni potrebbero rompersi in vari frammenti”, invece di dare nuovi elementi. L’idea della Noddack fu considerata inaccettabile e addirittura ridicola, ma la storia le ha dato ragione.
Un ulteriore esempio di grande scienziata è senza dubbio quello di Lise Meitner che lavorò a lungo con Otto Hahn stabilendo un sodalizio durato praticamente tutta la vita. Assieme scoprirono il primo isotopo radioattivo a vita lunga del protoattinio, ma, soprattutto, assieme lavorarono al “progetto transuranio” con l’obiettivo di verificare se, bombardando con neutroni l’atomo di uranio, si poteva ottenere il processo di fissione, ipotizzato anni prima dalla Noddack. Lise, essendo ebrea, dovette lasciare la Germania, ma continuò a collaborare a questo progetto anche dalla Svezia in cui di era rifugiata; infatti, appoggiandosi ai dati sperimentali ottenuti da Hahn, scrisse un articolo nel quale forniva l’interpretazione teorica del processo di fissione nucleare. Hahn ebbe il premio Nobel per la Chimica con la seguente motivazione “per la scoperta della fissione dei nuclei atomici pesanti”; la Meitner non solo non lo ricevette, ma non fu neanche citata da Hahn nella sua Nobel lecture. La storia, però, non finisce qui, perché dopo il 1990 furono pubblicati i documenti della Commissione Nobel, a lungo secretati, e finalmente si capirono i veri motivi per l’esclusione della Meitner dal premio: Lise non ricevette il Nobel perché era una fisica, perché era ebrea e, cosa veramente incredibile, perché il Comitato non ebbe il tempo sufficiente per valutare con l’adeguata cura le candidature.
Come già detto, i nomi dimenticati di donne che hanno contribuito a far crescere la Tavola Periodica vanno ben oltre il breve elenco qui riportato; si possono però trovare tutti nel libro “Women in their Element”, curato da Annette Lykknes e Brigitte Van Tiggelen e pubblicato dalla World Scientific nel 2019, anno che le Nazioni Unite hanno dedicato alla Tavola Periodica per celebrare i 150 anni della sua nascita. È il giusto e doveroso riconoscimento per il lavoro delle “donne della Tavola Periodica, lavoro misconosciuto perché, nella maggioranza dei casi, esse collaboravano con colleghi uomini che si sono presi il pieno riconoscimento dei risultati ottenuti (Fig. 2, sinistra).
Ma questa è una cosa nota, tanto nota e comune da avere addirittura un nome: effetto Matilda. Il termine fu ideato nel 1993 dalla storica della scienza Margaret W. Rossiter in onore dell’attivista Matilda Joslyn Gage, che nel 1833 scrisse il saggio “Woman as an inventor” [1] in cui denunciava il fatto che diverse scoperte scientifiche e invenzioni erano il risultato del lavoro di donne, purtroppo, rimaste nell’anonimato (Fig. 2, destra).
Da quanto brevemente raccontato è evidente che l’evoluzione della Tavola Periodica è stata segnata da conflitti fra donne e uomini, conflitti che, purtroppo, sono ben presenti ancora oggi in ambito scientifico. Si tratta, comunque, sempre di storie tristi: tristi per le donne che non vedono riconosciuto il loro valore, tristi per gli uomini che mostrano il loro volto peggiore e tristi per la scienza perché i risultati migliori sono quelli che nascono dai sogni comuni di donne e uomini, da una rispettosa collaborazione e da una stima reciproca.

Fig. 2. Due testi che celebrano il contributo delle donne allo sviluppo della chimica e della scienza.
3. Elemento: un concetto multiforme. Conferenza di Elena Ghibaudi (Dipartimento di Chimica – Università di Torino)
Il concetto di elemento chimico è un concetto fondante della Chimica, ma – come spesso accade ai fondamenti delle discipline – il suo significato viene considerato scontato. Compito della filosofia della Chimica è proprio quello di promuovere la conoscenza e la riflessione sui concetti che fondano la disciplina chimica e la loro evoluzione storica. Tali concetti non sono mai statici, bensì soggetti a una evoluzione storica che riflette le sempre nuove esigenze conoscitive della disciplina di riferimento e un ottimo esempio di questa dinamica storico-epistemologica è proprio la storia del concetto di elemento.
È ben noto che Lavoisier definisce l’elemento come termine ultimo dell’analisi: “Tutte le sostanze che non siamo ancora riusciti a decomporre con alcun mezzo sono per noi degli elementi”. Questa definizione è figlia di una doppia esigenza: analitica (quando posso dire di essere giunto al termine del procedimento di scomposizione chimica della materia) ed epistemologica (affermare la preminenza dell’indagine empirica sulla Filosofia, quale strumento conoscitivo della realtà materiale).
Un secolo dopo, Mendeleev definirà l’elemento in modo del tutto differente: “L’ossido di mercurio non contiene due sostanze semplici, un gas e un metallo, ma due elementi, il mercurio e l’ossigeno, che, quando sono liberi, sono un metallo e un gas. Né il mercurio come metallo né l’ossigeno come gas sono contenuti nell’ossido di mercurio, il quale contiene soltanto le loro essenze”. Mendeleev aveva l’esigenza di individuare e definire l’invariante di una trasformazione chimica e di farne la base per la classificazione periodica. Solo un concetto astratto poteva rispondere a questa esigenza, in quanto la sostanza semplice di Lavoisier non si preserva nelle reazioni cui partecipa.
Ulteriori sfide alla definizione di elemento sono emerse con la scoperta della divisibilità dell’atomo e dell’esistenza degli isotopi, che porterà a mutare uno dei due criteri ordinatori della Tavola Periodica. Eppure, è lo stesso Soddy a riconoscere il significato e la funzione – centrale per la Chimica – del concetto (astratto) di elemento: “Il carattere elementare e perfino l’omogeneità hanno abbandonato (have departed from) il concetto di elemento chimico, ma il concetto rimane e, comunque scegliamo di chiamarlo, rimarrà”.
Infine, va segnalato che la IUPAC ammette due differenti (e parzialmente contraddittorie) definizioni di elemento: 1) Una specie di atomi: tutti gli atomi con lo stesso numero di protoni nel nucleo atomico; 2) Una sostanza chimica pura composta di atomi con lo stesso numero di protoni nel nucleo atomico. Talvolta questo concetto è denominato sostanza elementare per distinguerlo dall’elemento così come è definito al punto 1, ma nella maggior parte dei casi il termine elemento è usato per entrambi i concetti.
Questo breve percorso storico ed epistemologico evidenzia che qualsiasi identificazione dell’elemento con un ente materiale (sostanza, atomo o nucleo) è problematica ai fini dell’identificazione dell’elemento stesso come invariante di una trasformazione chimica. Solo una concezione astratta di elemento (inteso come categoria di enti identificabili mediante il numero atomico Z) consente di affermare che esso si conserva nelle trasformazioni chimiche e che la Tavola Periodica è una classificazione di elementi. È pertanto auspicabile adottare una terminologia accurata, che distingua tra sostanza semplice (concreta) ed elemento (categoria astratta alla base della classificazione periodica).
4. Partendo dal “Caos Primordiale” e grazie alle “Fucine del Cielo” si arriva fino a noi: formidabile! Conferenza di Flavio Fusi Pecci (Osservatorio di Astrofisica e Scienza dello Spazio; Istituto Nazionale di Astrofisica – Bologna)
Ai nostri giorni, grazie alle osservazioni fotometriche e spettroscopiche con telescopi e satelliti, alla varie frequenze di stelle e galassie e ai paralleli studi ed esperimenti di laboratorio di Chimica e Fisica fondamentale (incluso, ad esempio, il CERN di Ginevra, i Laboratori INFN del Gran Sasso, i rivelatori di neutrini e Onde Gravitazionali) siamo in grado di costruire un quadro interpretativo: partendo dal Big Bang, 13-14 miliardi di anni di anni fa, sono nate le prime stelle, contenenti idrogeno ed elio e, da lì, tramite le varie catene di reazioni nucleari che sono avvenute e avvengono in tutte le stelle (Sole compreso), si sono via via formati tutti gli elementi conosciuti.
In poche parole, quindi, osservando, studiando e capendo approfonditamente la vita, morte e miracoli di tutte le stelle (Sole, stelle più piccole e più grandi, nebulose planetarie, nane bianche, supernove, stelle di neutroni, pulsar, buchi neri, etc.) possiamo disporre di un formidabile e vastissimo laboratorio naturale di come tutto ciò che è alla base nella nostra vita sia stato formato.
Uno dei più grandi successi dell’Astrofisica moderna è, infatti, proprio la descrizione della nucleosintesi di tutti gli elementi chimici tramite la griglia delle reazioni nucleari. La famosa Tavola Periodica di Mendeleev, che tutti studiamo a scuola in Chimica, può essere spiegata e descritta partendo dalle stelle, non solo nelle proprietà dei singoli elementi lì contenuti, ma anche nelle abbondanze relative. Ad esempio, si ricava immediatamente che gli elementi fondamentali per la vita, C, N, O, Fe, etc., sono quelli più facilmente prodotti e abbondanti nelle stelle. È per questo che siamo fatti soprattutto da questi e non da altri.
In conclusione, poiché l’idrogeno che è nell’acqua e che è alla base della vita, di tutti gli animali e piante compresi, è stato prodotto nell’universo primordiale, dopo soli tre minuti dal Big Bang, e poiché gli altri elementi sono stati via via prodotti dalle stelle, noi, proprio noi, tutti indistintamente, siamo testimoni del Big Bang e siamo davvero figli delle stelle! Un cantante, Alan Sorrenti, nel 1977 ce lo ha poeticamente segnalato e ricordato con la sua splendida canz ne. Abbiamo tutti le stesse radici, non va dimenticato. Viviamo in pace dunque!
5. La Tavola Periodica: nonostante i suoi anni ha ancora tanto da insegnarci. Conferenza di Nicola Armaroli (Istituto ISOF – CNR di Bologna)
Studiando l’immensità al di fuori del minuscolo pianeta Terra, abbiamo scoperto che ogni angolo dell’Universo ha una composizione chimica specifica. Limitandoci al nostro Sistema Solare, sappiamo che Mercurio, Venere e Marte sono tre pianeti a noi vicini ma chimicamente molto diversi. La Terra è a sua volta un unicum assoluto: una meravigliosa nicchia di vita che racchiude una varietà enorme di risorse naturali di origine biologica e minerale. Essa è in grado di rigenerare (entro certi limiti e con i suoi ritmi) una parte delle risorse di cui dispone (ad es., acqua dolce, ossigeno, suolo, specie viventi vegetali e animali), ma altre sono presenti in quantità sostanzialmente immutabili. Tra queste spiccano gli elementi chimici, che preleviamo dalla crosta terrestre e, in misura minore, dall’atmosfera, per soddisfare le esigenze materiali di una popolazione mondiale sempre più numerosa ed esigente. In questo contesto, ecco l’importanza della Tavola Periodica quantitativa della Terra, una sorta di carta di identità chimica del nostro pianeta che è stata recentemente proposta dalla Società Chimica Europea, EuChemS (Fig. 3) [2].
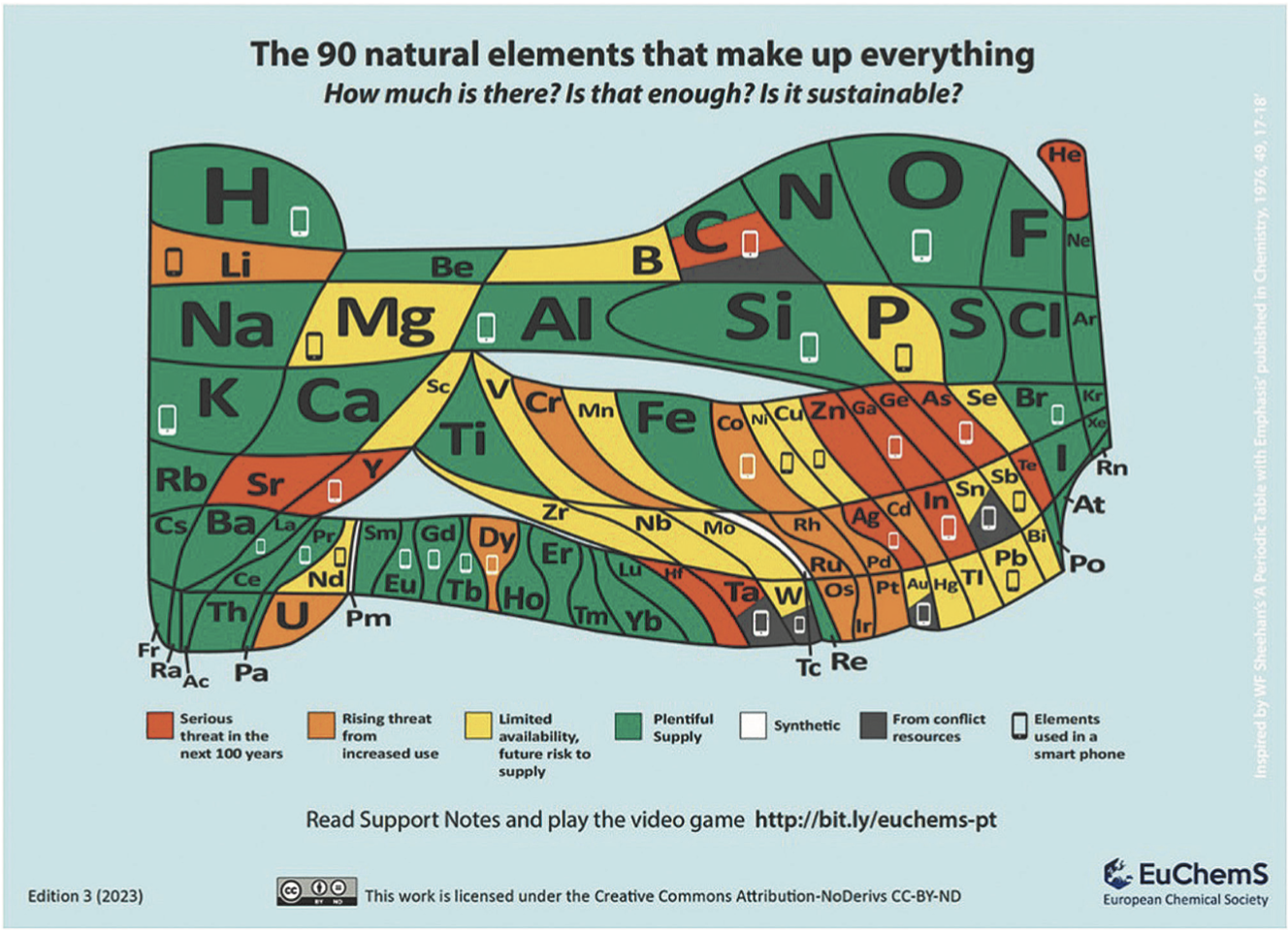
Fig. 3. Tavola Periodica quantitativa proposta da EuChemS, versione aggiornata al 2023.
In questa tavola non convenzionale, l’area assegnata ad ogni elemento riflette la sua abbondanza relativa. La scala non è lineare ma logaritmica, perché alcuni elementi sono così rari sulla Terra che la loro casella risulterebbe invisibile all’occhio. I colori, invece, raccontano l’utilizzo degli elementi da parte dell’umanità: si passa dal verde (elementi la cui disponibilità non sarà un problema per molti secoli a venire) al rosso (elementi a “rischio estinzione” entro l’attuale secolo a causa dell’uso intensivo che ne facciamo), passando per l’arancione e il giallo. Un’icona smartphone indica gli elementi presenti in questo dispositivo, che risulta una sorta di collezione ambulante della Tavola Periodica, dato che contiene oltre 30 elementi. Negli anni Novanta, in un’intera casa, c’erano circa venti elementi, oggi ne possiamo tenere molti di più sul palmo della mano! Lo smartphone rappresenta un grande paradosso della civiltà tecnologica: da un lato è un campione della dematerializzazione, perché può sostituire moltissimi oggetti (orologio, calcolatrice, bussola, agenda, fotocamera, ecc.), dall’altro, però, è un campione della “intensificazione materiale”, dato che, per svolgere tutte le sue numerose e sofisticate funzioni, richiede un uso intensivo di elementi chimici.
Tra gli elementi che attualmente meritano particolare attenzione a causa della crescente importanza e delle risorse relativamente limitate spiccano l’elio (fondamentale nelle apparecchiature NMR per la diagnostica medica e l’analisi chimica), il litio (essenziale per lo sviluppo delle batterie e la decarbonizzazione dei trasporti), l’indio (insostituibile componente nei display degli apparecchi elettronici) e le terre rare (14 elementi impiegati in una vastità di applicazioni).
L’Unione Europea è relativamente povera di risorse minerali, ma detiene una possente industria manifatturiera. Per questo motivo cura una lista di materiali critici per la propria economia, che viene periodicamente aggiornata. Attualmente, purtroppo, il tasso di riciclo degli elementi chimici in Europa è troppo basso e occorre un drastico cambio di rotta, per passare con decisione dalle parole ai fatti in materia di economia circolare. Questo è più che mai urgente se si considera che, attualmente, la circolarità dell’economia mondiale è stimata inferiore al 9%. Cioè meno del 9% dei circa 100 Gton di materiali che entrano nell’economia mondiale rientra nei processi produttivi.
La tavola periodica è un documento dinamico, continuamente aggiornato in funzione degli sviluppi industriali e tecnologici, che cambiano i profili di utilizzo dei diversi elementi. L’obiettivo di questo strumento conoscitivo e didattico è accrescere la consapevolezza generale delle persone sull’intrinseca limitatezza delle risorse minerali del nostro pianeta, anche per promuovere un ripensamento dei nostri stili di consumo. Se un oggetto a fine vita viene smaltito come rifiuto indifferenziato, gli elementi chimici di cui è fatto non sono persi, ma dispersi. In altre parole, rimangono sulla Terra ma, dissolti in mille rivoli nell’ambiente, non potranno mai più essere recuperati. Di fatto, li perdiamo per sempre.
6. Il concetto di periodicità: il punto di vista della Chimica. Conferenza di Luca Prodi (Dipartimento di Chimica “Giacomo Ciamician” – Università di Bologna)
La Tavola Periodica, così come la conosciamo adesso, ci fa vedere quali sono gli attrezzi – gli atomi di diversi elementi – con cui è costruito il mondo, compresi noi esseri viventi, e con i quali possiamo aspirare a rispondere con successo anche alle sfide più importanti che abbiamo davanti, tipo un cibo di qualità per tutta l’umanità, la salute, l’energia e la sostenibilità dell’ambiente. Gli atomi sono come dei mattoncini Lego, con i quali sono formate molecole molto semplici, ad esempio l’acqua (costituita da un atomo di ossigeno e due di idrogeno), il diossido di carbonio (contenente un atomo di carbonio e due di ossigeno), ma anche molecole molto complesse, come l’emoglobina, necessaria per il trasporto dell’ossigeno nel nostro corpo, che è formata da 9072 atomi (la formula è C2954H4516N780O806S12Fe4), tutti aventi un ordine preciso (e uguale per tutte le molecole di emoglobina) all’interno della struttura. Per costruire sia le molecole più semplici che quelle più complesse, sia ancora per costruire insiemi ordinati di molecole (chiamati sistemi supramolecolari) è necessario conoscere le proprietà di ogni atomo. Sappiamo ora (cosa non nota al tempo della prima Tavola Periodica di Mendeleev) che al centro di ogni atomo c’è un nucleo, formato da protoni e neutroni. Ora sappiamo che le proprietà chimiche di un atomo dipendono essenzialmente proprio dal numero di protoni, detto numero atomico, che corrisponde anche al numero di elettroni (dotati della stessa carica dei protoni, ma di segno opposto, e circa 2000 volte più leggeri) che compongono l’atomo stesso, e la Tavola Periodica mette innanzitutto gli elementi in ordine rispetto al numero atomico. È la meccanica quantistica (sufficientemente complessa da far dire a Niels Bohr che “se non sei completamente confuso dalla meccanica quantistica, allora non la stai davvero capendo”), maturata all’inizio del secolo scorso, che ci permette di predire come si comportano gli elettroni intorno al nucleo. Occorre, però, abbandonare alcuni concetti a cui siamo abituati nella vita di tutti i giorni: non potendo conoscere con sufficiente precisione (nella dimensione atomica) sia la posizione che la velocità degli elettroni, non possiamo conoscerne la traiettoria, come invece possiamo fare con i pianeti del nostro sistema solare o con un pallone da calcio. L’informazione che possiamo avere è la probabilità che essi si trovino in una certa zona dello spazio intorno al nucleo: questa è legata a una funzione matematica – soluzione di un’equazione differenziale – che è chiamata orbitale. Tre numeri quantici ne caratterizzano l’energia, la forma e l’orientazione nello spazio; normalmente gli elementi hanno proprietà simili quando il numero di elettroni negli orbitali più esterni e il loro modo di occuparli sono uguali; in questo caso gli elementi si trovano nella stessa colonna (gruppo) della tavola, il che appunto ne spiega la periodicità. Simile, però, non vuol dire uguale, come ci ricorda anche Primo Levi nel suo bellissimo libro Il Sistema Periodico: “occorre diffidare del quasi-uguale, del praticamente identico […] Le differenze possono essere piccole, ma portare a conseguenze radicalmente diverse; il mestiere del chimico consiste in buona parte nel guardarsi da queste differenze, nel conoscerle da vicino, nel prevederne gli effetti”. Ma, poi, Levi aggiunge: “non solo il mestiere del chimico”.
7. Il concetto di periodicità: il punto di vista della Fisica Nucleare. Conferenza di Maurizio Spurio (Dipartimento di Fisica e Astronomia “Augusto Righi” – Università di Bologna)
La Tavola Periodica degli elementi rappresenta una regolarità, uno schema. E ogni volta che incontriamo uno schema, siamo di fronte a una legge della Natura. La regolarità della Tavola Periodica è determinata dalle leggi dell’elettromagnetismo, inquadrate nel mondo microscopico dalla meccanica quantistica. La Tavola e le proprietà chimiche dipendono esclusivamente dalla carica elettrica del nucleo e, quindi, da quanti elettroni atomici sono presenti e da come essi si dispongono su orbitali di forma diversa.
Quantitativamente, gli elettroni atomici sono vincolati ai nuclei a distanze dell’ordine di 10–10 m con un’energia di legame dell’ordine di 10 eV (gli eV sono un’unità di misura dell’energia usata in fisica atomica e nucleare, ma non solo). I protoni (e i neutroni) sono vincolati all’interno dei nuclei a distanze di 10–15 m ed energie dell’ordine di 1 milione di eV. Per intenderci, se un nucleo avesse le dimensioni di una moneta da 1 euro, gli elettroni atomici orbiterebbero attorno a distanze dell’ordine di 1 km.
Questo comporta che le scale di energia delle particelle nei nuclei sono enormemente mag- giori di quelle degli elettroni negli orbitali atomici e che i fenomeni atomici e nucleari sono totalmente sconnessi. L’interazione che lega protoni e neutroni nei nuclei è totalmente diversa e molto più forte dell’interazione elettrica che lega gli elettroni ai nuclei. Dunque, la Tavola di Mendeleev non ha praticamente alcun senso dal punto di vista della Fisica dei nuclei.
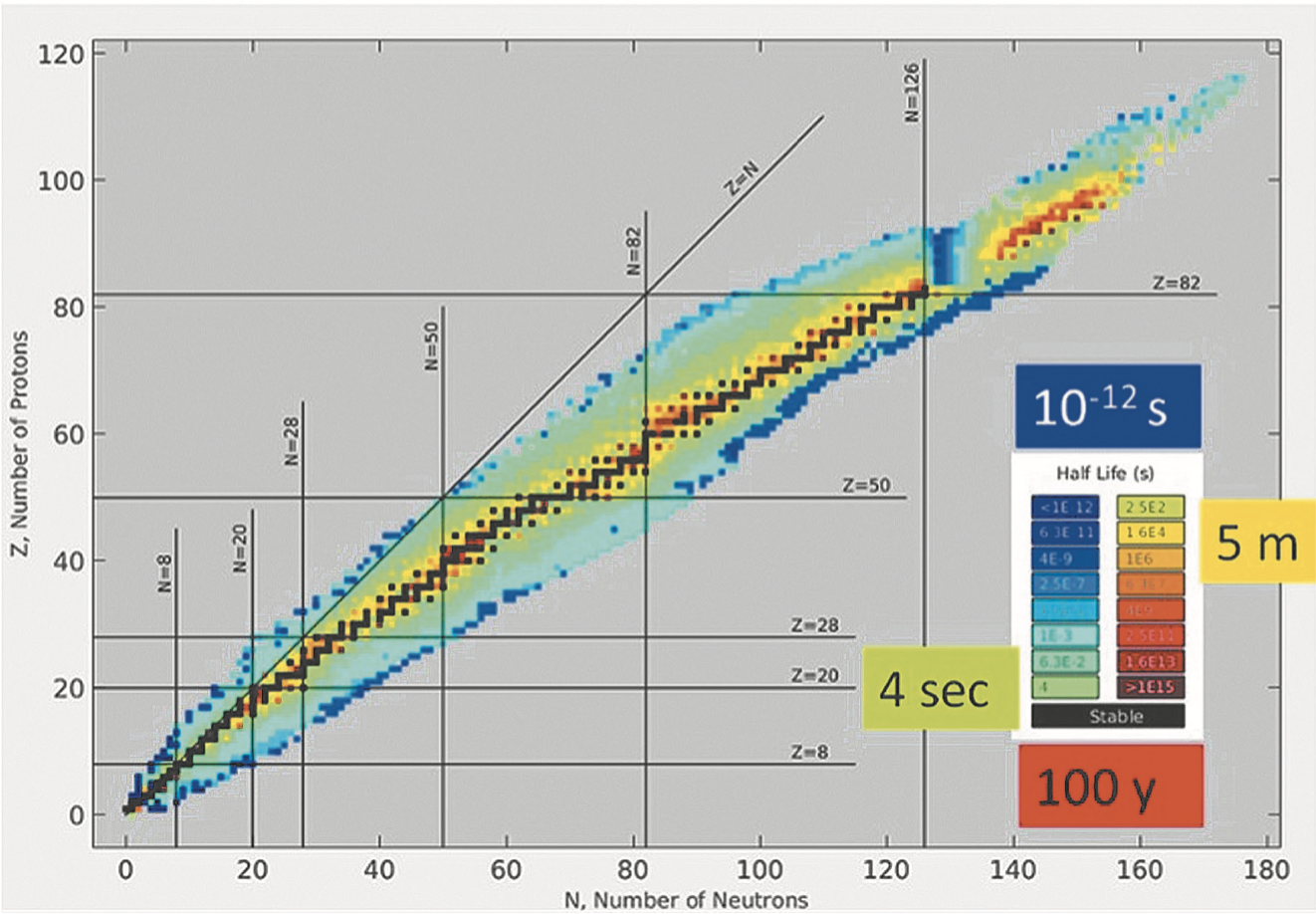
Fig. 4. Stabilità dei nuclei in funzione del numero dei neutroni (ascissa) e del numero dei protoni (ordinata).
Per la fisica dei nuclei quello che conta è il numero di protoni (Z) e di neutroni (N) presenti nel nucleo stesso. Mentre le reazioni chimiche “sentono” Z (che corrisponde al numero di elettroni atomici), le proprietà nucleari dipendono dalla somma A = Z + N e da quanti protoni/ neutroni sono presenti. La Figura 4 mostra i nuclei “viventi” in funzione del numero di neutroni (in ascissa) e protoni (in ordinata). Per nuclei “viventi” si intende non solo che esistono, ma (come le diverse specie di animali) che hanno una vita media caratteristica.
I nuclei che vivono “in eterno” (che, per un fisico, significa nuclei con vita media enormemente più grande di quella dell’Universo, che è di 13 miliardi di anni) sono quelli al centro della regione colorata e indicati in nero. In pratica, le leggi che regolano la fisica dei nuclei preferiscono che i nuclei stabili abbiano un numero Z vicino (o leggermente inferiore) a N. A mano a mano che ci si allontana da questa regione centrale (ossia, il nucleo contiene troppi neutroni o troppi protoni), la sua vita media decresce. Ad esempio, i nuclei in figura con colore rosso vivono circa 100 anni, quelli gialli 5 minuti, i verdi 4 secondi e quelli blu 1 millesimo di miliardesimo di secondo (10–12 s). La zona grigia comprende i nuclei con valori di Z e N tali per cui che, se si formassero con qualche processo, vivrebbero così poco da non riuscire a evidenziarli.
In pratica, ci sono circa 150 nuclei stabili (gli elementi sino all’Uranio che compongono la Tavola Periodica, alcuni dei quali hanno più di un isotopo stabile) e oltre 1500 nuclei “radioattivi”, che si trasformano, cioè, con processi fisici naturali in altri elementi, con vite più o meno lunghe.
Questa è la regolarità esistente nella fisica dei nuclei: la vita media di un elemento con Z protoni e N neutroni dipende da questi due numeri e possiamo determinarla (con una teoria fisica nata da Enrico Fermi nel 1934 e poi perfezionata nei decenni successivi).
Inoltre, la fisica nucleare prevede che non ci siano elementi con A > 240. Quando un nucleo è composto da troppi protoni e neutroni, preferisce scindersi in due parti (“fissionare”, in termine tecnico). Questo è un aspetto importante per l’Universo: gli elementi presenti nel Sistema Solare sono tutti e i soli che possono formarsi in Natura. Ci si può domandare, guardando un bellissimo film come Avatar 1, “c’è un pianeta dove possa esistere l’unobtanium, ossia un elemento con proprietà fisico/chimiche sconosciute sulla Terra?” Questa domanda, in base alla Fisica nucleare, ha una secca risposta: no!
Come possiamo esserne certi? Misurando con strumenti opportuni, fuori dell’atmosfera terrestre, l’arrivo di raggi cosmici. Si tratta di protoni e nuclei in arrivo dallo spazio e accelerati da sorgenti galattiche ed extragalattiche (le stesse che formano i nuclei con Z > 2). Nei raggi cosmici, si osservano solo e soltanto i nuclei stabili che conosciamo sulla Terra. Ma i dettagli verranno raccontati in una prossima occasione.
8. La Tavola Periodica a scuola. Conferenza di Eleonora Aquilini (Presidente della Divisione di Didattica della SCI), Carlo Fiorentini (Presidente del CIDI di Firenze), Antonio Testoni (Divisione di Didattica della SCI)
Per comprendere la Tavola Periodica, è fondamentale avere un’idea del processo che ha permesso:
- la creazione della Tavola Periodica di Mendeleev (1869),
- l’individuazione, all’inizio del Novecento, del numero atomico come criterio ordinatore degli elementi al posto del peso atomico.
Come sviluppare questi temi nella scuola secondaria di secondo grado? La narrazione è sicuramente la modalità privilegiata, la forma espressiva da sempre utilizzata nella storia dell’essere umano per attribuire significati a tutto ciò che ci circonda: “Non intendo sottovalutare l’importanza del pensiero logico-scientifico […] Ma non è un mistero che a molti giovani che oggi frequentano la scuola, la scienza appaia “disumana”, “fredda” e “noiosa”, malgrado gli eccezionali sforzi degli insegnanti di scienze e di matematica e delle loro associazioni. Può darsi che abbiamo sbagliato staccando la scienza dalla narrazione della cultura […] Solo la narrazione consente di costruirsi un’identità e di trovare un posto nella propria cultura. Le scuole devono coltivare la capacità narrativa, svilupparla, smettere di darla per scontata […] Non sto proponendo di sostituire alla scienza la storia della scienza. Sostengo invece che la nostra istruzione scientifica dovrebbe tener conto in ogni sua parte dei processi vivi del fare scienza, e non limitarsi a essere un resoconto della “scienza finita” quale viene presentata nel libro di testo, nel manuale e nel comune e spesso noioso esperimento di dimostrazione” [3]. Il criterio ordinatore principale alla base della Tavola Periodica degli elementi di Mendeleev è stato il peso atomico. Comprendere il significato del concetto di peso atomico e il processo che ha permesso alla comunità dei chimici, dopo il congresso di Karlsruhe (1860), di determinare i pesi atomici con una modalità condivisa ed efficace sono passaggi, secondo gli autori del contributo, ineludibili non solo storicamente, ma anche didatticamente. La storia del peso atomico è, inoltre, inscindibilmente legata alla possibilità di scrivere le formule in modo univoco ed esatto. Per questo assume un’importanza cruciale la teoria atomica di Dalton, la teoria che, non solo, permette di “spiegare il visibile complicato, per mezzo dell’invisibile semplice” [4], ma anche di quantificare l’infinitamente piccolo introducendo, per l’appunto, i primi concetti di peso atomico e di formula. Si tratta di concetti che verranno in seguito affinati fino alla geniale elaborazione di Cannizzaro che fu decisiva per la stesura della Tavola Periodica di Mendeleev, una sistematica che presentava però alcune “forzature” come, ad esempio, l’inversione nella successione dei pesi atomici del nickel e del cobalto. In tal senso, il contributo di Moseley fu decisivo nell’individuare il numero atomico come vero e proprio criterio ordinatore degli elementi. Stabilendo che il numero atomico e non il peso atomico è la proprietà che determina l’ordine di successione degli elementi si realizza, come sottolinea Bachelard, un primo “sconvolgimento semantico” in seno alla Tavola Periodica: “All’inizio questo numero atomico era un vero numero ordinale; era, insomma, il numero che fissava il posto di sostanze elementari nelle serie delle linee orizzontali della tavola di Mendeleev. Filosoficamente il progresso compiuto al livello della nozione di numero atomico è consistito precisamente nel suo passaggio da funzione ordinale alla funzione cardinale. Ci si è potuti rendere conto che con questa nozione non solo si ordinavano gli elementi ma si contava qualcosa” [5]. Se con il peso atomico, come criterio ordinatore, si è potuto stabilire quale elemento precedeva l’altro, con il numero atomico si è andati alla “conta” degli elementi: per la prima volta è stato possibile stabilire, non solo la successione, ma anche il numero degli elementi compresi fra il primo e l’ultimo e il numero di quelli ancora da scoprire. In sostanza, con l’introduzione del numero atomico la sistematica di Mendeleev veniva fondata su una nozione più profonda e meno intuitiva rispetto al peso atomico: la nozione di struttura atomica. E a proposito del legame fra la Tavola Periodica e le prime concezioni della struttura atomica, illuminanti sono queste considerazioni di Bohr: “La caratteristica variazione delle proprietà degli elementi col numero atomico, come risulta dal sistema periodico, fornisce un’utile guida per la soluzione del problema che riguarda la disposizione degli elettroni nell’atomo. Per interpretare il sistema periodico è necessario supporre che gli elettroni siano suddivisi nell’atomo in gruppi distinti, in modo che la suddivisione in gruppi degli elementi corrisponda alla graduale formazione dei gruppi elettronici al crescere del numero atomico” [6].
Bibliografia
1. Gage, M.J. Woman as an Inventor. North Am. Rev. 1883, 136 (318), 478-489.
2. Euchems.eu. Available online: https://www.euchems.eu/euchems-periodic-table/ (accessed on 13 June 2023).
3. Bruner, J. La cultura dell’educazione. Feltrinelli: Milano, 1997.
4. Perrin, J. Gli atomi. Editori Riuniti: Roma, 2014.
5. Bachelard, G. Il materialismo razionale. Dedalo Edizioni: Bari, 1993.
6. Bohr, N. Teoria dell’atomo e conoscenza umana. Mimesis: Milano, 2018.


